
อิเล็กโทรลิซิส (Electrolysis) คือกระบวนการผ่านกระแสไฟฟ้า (D.C.) จากภายนอกเข้าไปในสารละลายอิเล็กโทรไลต์ แล้วทำให้เกิดปฏิกิริยาเคมี ตัวอย่างเช่น อิเล็กโตรลิซึม และการชุบ (ขบวนการที่ผ่านกระแสไฟฟ้า ทำให้เกิดปฏิกิริยาเคมี)
เครื่องมือที่ใช้แยกสารละลายด้วยไฟฟ้าเรียกว่า เซลล์อิเล็กโทรไลต์ หรืออิเล็กโทรลิติกเซลล์ ประกอบด้วย ขั้วไฟฟ้า ภาชนะบรรจุสารละลายอิเล็กโทรไลต์ และเครื่องกำเนิดกระแสตรง (D.C) เช่น เซลล์ไฟฟ้า หรือ แบตเตอรี่
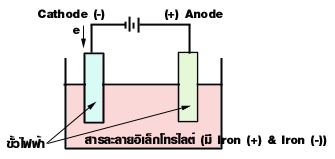
ขั้วไฟฟ้า (Electrode) คือแผ่นตัวนำที่จุ่มในสารละลายอิเล็กโทรไลต์ แล้าต่อกับเซลล์ไฟฟ้าหรือแบตเตอรี่ แบ่งเป็นแอโนด และ แคโทด
สารละลายอิเล็กโทรไลต์ คือสารละลายที่นำไฟฟ้าได้ เพราะมี Iron (+) + Iron(-)
Iron (+) วิ่งไปรับอิเล็กตรอนที่ขั้วลบ เกิดปฏิกิริยารีดักชัน จึงเรีบกขั้วลบว่า แคโทด และเรียกไอออนบวกว่า แคตไอออน (cathion)
Iron (-) วิ่งไปให้ e- ที่ขั้วบวกเกิดปฏิกิริยาออกซิเดชัน เรียกว่า แอโนด และเรียก Iron (-) ว่า แอนไอออน (Anion)
ดังนั้น ที่ Anode มี Anion คือ ไอออนลบ และที่ Cathode มี Cathion คือ Ion บวก
Anode (oxidation) ตรงกับขั้วบวก Cathode (Reduction) ตรงกับขั้วลบ
 แหล่งอ้างอิง: 1. เอกสารประกอบคำบรรยาย วิชาเคมี ของโครงการส่งเสริมความสามารถพิเศษภาคฤดูร้อน Brands's Summer Camp'95 มหาวิทยาลัยเกษตรศาสตร์
แหล่งอ้างอิง: 1. เอกสารประกอบคำบรรยาย วิชาเคมี ของโครงการส่งเสริมความสามารถพิเศษภาคฤดูร้อน Brands's Summer Camp'95 มหาวิทยาลัยเกษตรศาสตร์
2. หนังสือเรียนวิชาเคมี 3 ว 037 ฉบับปรับปรุง พ.ศ. 2533 ของกระทรวงศึกษาธิการ จัดทำโดยสถาบันส่งเสริมการสอนวิทยาศาสตร์และเทคโนโลยี พิมพ์ครั้งที่หนึ่ง พ.ศ. 2541





