

| Zn2+ + 2e | ---> Zn | E0 = -0.76
| Fe2+ + 2e
| ---> Fe | E0 = -0.44
| Cl2 + 2e
| ---> 2Cl- | E0 = +1.36
| H2 + 2e
| ---> 2H+ | E0 = 0.00
| Cu2+ + 2e
| ---> Cu | E0 = +0.34
| |
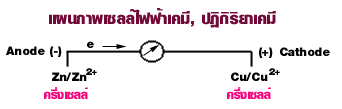
ความ| = ศักย์ | = ศักย์ = Cu - Zn = +0.34 - (-0.76) = +1.10 Volts |
| ปฏิกิริยา | ครึ่ง ครึ่ง ทั้ง Zn + Cu2+ ---> Cu + Zn2+ |
